Mit einem neuen Mikro Array Genchip die Erreger von Rasenkrankheiten schnell und sicher analysieren
von: Dr. Fritz LordRasenkrankheiten, verursacht durch verschiedene pilzliche Krankheitserreger, können zum Teil erhebliche Schäden verursachen und die Funktionalität von Rasenflächen negativ beeinträchtigen. Aus diesem Grunde werden in der Praxis Pflanzenschutzkonzepte basierend auf Kontrolle, Vorbeuge und, wenn erforderlich, auch Bekämpfung mit zugelassenen und genehmigten Wirkstoffen angewendet.
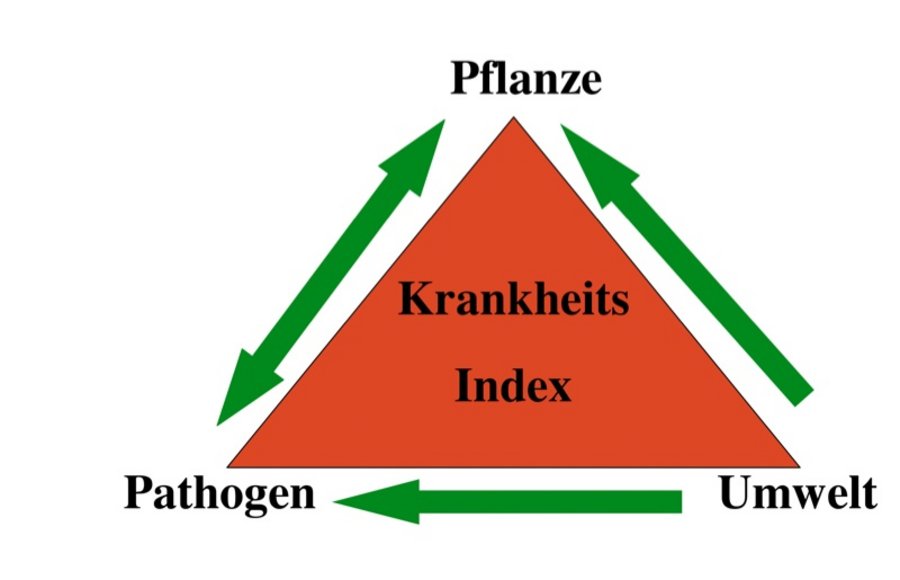
Seit dem 1. Januar 2014 ist die Einhaltung der Richtlinien des Integrierten Pflanzenschutzes (IPS) verpflichtender Bestandteil der professionellen Rasenpflege zum Beispiel auf Golf- und Sportplätzen. Ziel ist es, den Pflanzenschutzmitteleinsatz auf ein absolut notwendiges Maß zu reduzieren und prophylaktische Maßnahmen zu forcieren. Gesunde und intakte Pflanzen sind relativ schwer zu befallen, insbesondere bei geringem Infektionsdruck. Aus dem Interaktionsdreieck in Abbildung 2 wird ersichtlich, dass Krankheitserreger die Pflanze zwar angreifen können, aber auch auf effektive pflanzeneigene Abwehrmechanismen stoßen. Es besteht also kein einseitiges Prinzip. Das Pathogen wirkt auf die Pflanze und die Pflanze auch direkt oder indirekt auf das Pathogen (Doppelpfeil). Umwelt- bzw. Standortbedingungen beeinflussen sowohl Pflanzenwachstum als auch die Entwicklung des Krankheitserregers. Die Schaffung günstiger Wachstumsbedingungen für die Gräser und die Unterdrückung krankheitsfördernder Faktoren (z. B. lang anhaltende Blattfeuchte) sind also bereits praktizierter integrierter Pflanzenschutz.
Vorbeugende Maßnahmen im Integrierten Pflanzenschutz (IPS) im Rasen:
- Schaffung und Erhalt optimaler Bodenbedingungen/Rasentragschichten (DIN-18035/4)
- Verwendung geeigneter RSM-Rasenmischungen mit Krankheits toleranten Sorten
- Ausgeglichene Nährstoffversorgung
- Spurennähstoffe wie Eisen, Mangan, Molybdän, Kupfer und Zink beachten
- Einsatz von natürlichen Gegenspielern (Antagonisten)
- Applikation von Biostimulantien (z.B. Algenextrakte) zur Erhöhung der Stresstoleranz
- Antitaubehandlung
- Filzreduzierung
- Regelmäßige Kontrollen
NL-Stellenmarkt

Die genaue Kenntnis über die Biologie des jeweiligen Schaderregers und vor allem ein rechtzeitiges und präzises Erkennen der Krankheit sind somit wesentliche Faktoren des IPS. Bei der Diagnose von Krankheitserregern im Rasen werden zurzeit noch überwiegend klassische optische Analyseverfahren verwendet. In der Regel werden aufbereitete Proben symptomatischer Pflanzen auf Agarplatten mit spezifischen Nährmedien ausgelegt (Abb. 3), im Klimaschrank unter erregerspezifischen Bedingungen bebrütet (inkubiert) (Abb. 4), um dann, nach Erstellung eines mikroskopischen Präparates, mit dem Mikroskop untersucht werden zu können (Abb. 5).
Auf Basis morphologischer Differenzierungsmerkmale wie zum Beispiel Form und Septierung von Makrokonidien, Hyphen, Form der Konidienträger (Abb. 6) erfolgt die Bestimmung des ursächlichen Erregers. Diese Prozedere ist jedoch zeit- und arbeitsaufwändig, fehleranfällig und gerade bei den häufig vorliegenden Mischinfektionen schwierig eindeutig zu interpretieren. Zudem kann bei bestimmten Erregern mit ähnlichen Merkmalen innerhalb einer Gattung nicht immer zweifelsfrei bis in die Art oder gar in die forma specialis-Ebene bestimmt werden. Es ist jedoch bekannt, dass beispielsweise in der Gruppe der Fusarien unterschiedlich aggressive oder virulente Arten auftreten ( 2002, 2000, 1986). Eine exakte Bestimmung des Erregers ist also auch für eine Entscheidung bezüglich der Wahl und Planung geeigneter und zielgerichteter Kontroll- oder Bekämpfungsmaßnahmen wichtig.
Im Unterschied dazu stellt das bereits Mitte der 1980er-Jahre entwickelte PCR-Verfahren (Polymerase-Chain-Reaction) eine relativ rasche und sichere Diagnose auf molekularbiologischer Basis dar. Hierbei wird Erbsubstanz (DNA) in drei Schritten vervielfältigt.
- Denaturierung,
die DNA- Doppelhelix wird in ihre Einzelstränge geteilt - Hybridisierung (Annealing)
spezielle komplementäre Primer lagern sich an die Einzelstränge an - Elongation (Amplifikation)
thermostabile (Taq ) DNA-Polymerase füllt die fehlenden Stränge mit freien Nukleotiden auf. Die durch die Primer markierten DNA - Sequenzen werden kopiert.
Diese Schritte werden in jeweils 30 bis 50 Zyklen wiederholt, wobei die gebildeten Produkte eines abgeschlossenen Zyklus wiederum Ausgangsprodukte für den neuen Zyklus sind (Kettenreaktion), was eine enorme Vervielfältigungsleistung darstellt (Newton et Graham 1997). Die PCR-Methode wird auch für den sogenannten genetischen Fingerabdruck verwendet. Hier wird die aus einer Probe isolierte, vervielfältigte und schließlich durch spezielle Verfahren (Gel Elektrophorese) visualisierte DNA mit einer "Ziel"-DNA verglichen und auf Übereinstimmung geprüft. Es wird also nur der Erreger bestätigt oder verneint, für den im Vorfeld auch ein Verdacht bestand.
Eine neuartige und patentierte Methodik1)nutzt für die DNA-Vervielfältigung weiterhin die PCR Technik, jedoch kommt zusätzlich ein spezieller Mikro-Array-Genchip zum Einsatz, welcher die Gräserprobe in einem Reaktionsschritt auf 90 verschiedene pflanzen- bzw. gräserpathogene Mikroorganismen hin präzise prüft. Ein Anfangsverdacht ist nicht erforderlich. Dies kann wichtige Hinweise über den Krankheitsbefall der betroffenen Rasenflächen liefern und für die Planung geeigneter vorbeugender oder auch direkter effektiver Behandlungsmassnahmen genutzt werden.


Im ersten Schritt wird dabei die mikrobielle Erbsubstanz (DNA) aus einer Probe symptomatischen Rasens isoliert. In der Regel wird hierfür ein auffälliges Rasenstück (ca. 2 cm Durchmesser mit Wurzelansatz) mit einem speziellen Probenehmer aus einem bestimmten Areal des Befalls ausgestochen (Abb. 5). Da nur eine sehr geringe Probenmenge erforderlich ist, ist eine sorgfältige Probennahme für die Aussagekraft der Untersuchung entscheidend. Das Material wird vor der Analyse entsprechend bearbeitet, in ein Reagenzröhrchen verbracht, homogenisiert und mit einem flüssigem Agenz aufgeschwemmt. Aus diesem Homogenat wird wiederum eine kleine Menge entnommen und der DNA Extraktion zugeführt.
Die daraus gewonnene Mikroorganismen DNA wird unter Verwendung von spezifischen Primern vervielfältigt. Primer sind kurze DNA-Stücke (Nukleotisequenzen), die den zu vervielfältigen DNA Abschnitt flankieren und damit markieren. Sie sind also entscheidend dafür, welche DNA bei der folgenden PCR kopiert wird. So kann durch die Verwendung von sogenannten pilzspezifischen ITS-Primern die DNA von sämtlichen in der Probe enthaltenen Pilzen vervielfältigt werden.
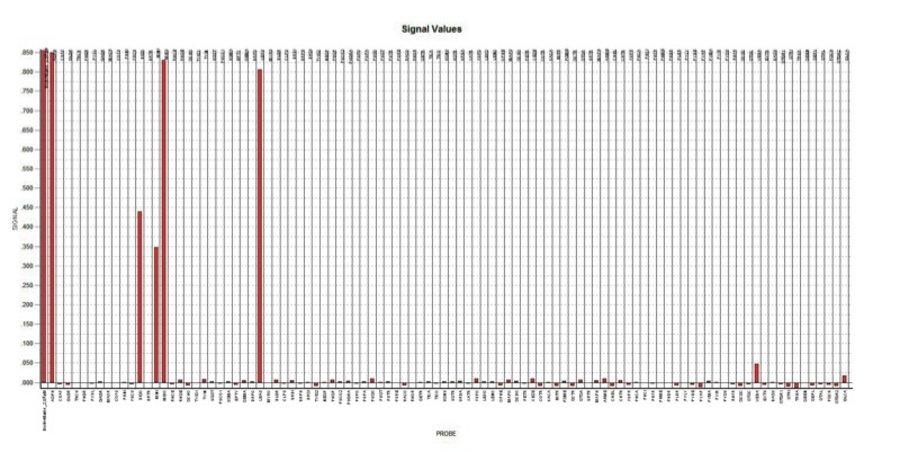
Der neu entwickelte Mikro-Array-Chip (Abb. 10) enthält eine Membran mit mikroskopisch kleinen Punkten. Auf jedem dieser Punkte haftet ein Stück spezifische DNA jeweils eines Erregers der 90 auf dem Genchip definierten Krankheiten. Tropft man nun das PCR-Gemisch auf den Chip, verbindet sich die aus der Rasenprobe isolierte und vervielfältigte DNA mit dem jeweils komplementären Stück DNA auf dem Chip. Durch eine biochemische Reaktion entsteht dann ein optisches Signal, welches mit dem Array-Reader erkannt werden kann. Abbildung 10 zeigt die Aufnahme eines Chips mit dem zugehörigen Schema, wobei jeder dunkle Punkt die Anwesenheit eines in der Probe erkannten Erregers zeigt. Die ganze Analytik dieser Methode dauert ab dem Erhalt der Probe nur 6-8 Stunden.
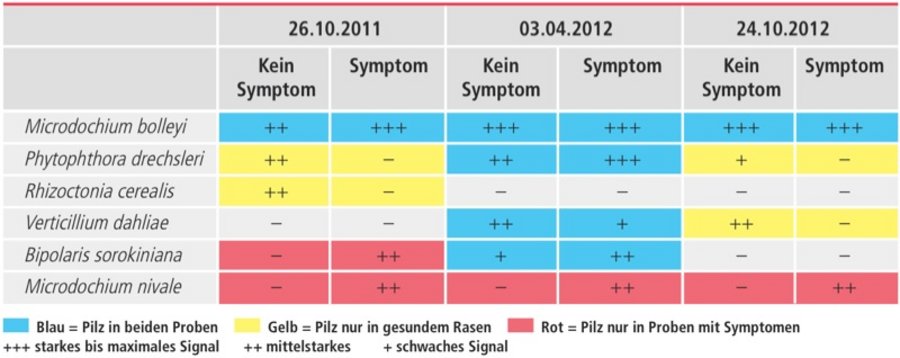
In einem Versuch wurden Golf- und Fußballplätze mit krankhaften Rasenstellen über mehrere Monate analytisch beobachtet. In Tabelle 1 sind Analyse-Ergebnisse aus einer Rasenfläche von drei verschiedenen Zeitpunkten und ein dazugehöriges Balkendiagramm der DNA-Chip Signale von der symptomatischen Probe vom 03.04.2012 (Abb. 9). Bemerkenswert ist, dass einige der pilzlichen Schaderreger auch in scheinbar gesunden, symptomlosen Gräsern nachgewiesen werden konnten. Dies deutet zunächst auf eine gewisse Toleranz gegenüber dem Schaderreger hin. Allerdings ist auch bekannt, dass vor allem bei Stressfaktoren (Bodenverdichtung, Nährstoffmangel, Tiefschnitt etc.) solche latente Infektionen in der Folge dann zu Schadsymptomen führen können.
Microdochium nivale ist der Erreger der bedeutendsten Pilzkrankheit im Rasen "Rosaroter Schneeschimmel", welche zwar bevorzugt bei Temperaturen von 0 bis 8 °C und hoher Luftfeuchtigkeit auftritt, aber je nach Witterung durchaus von September bis April auf Rasenflächen zu finden ist.
Microdochium bolleyi ist neben Colletotrichum graminicola ein weiterer Erreger der Anthracnose-Krankheit und wurde vermehrt auch in 2014 nicht nur auf Golfplätzen sondern auch auf sehr tief geschnittenen Fußballrasen diagnostiziert. Abbildung 9 zeigt das Diagramm der Chipsignale des Array Readers als grafisches Analyseergebnis der untersuchten Probe. Die Höhe der Balken zeigt die Signalstärke von Positivproben und von identifizierten Krankheitserregern. Auf der waagerechten Achse sind die Pathogene, die auf dem neu entwickelten Genchip fixiert sind, nacheinander aufgelistet.


Fazit
Regelmäßige visuelle Kontrollen des erfahrenen Greenkeepers bleiben auch weiterhin wichtige Grundlage für die Durchführung geeigneter Pflanzenschutzmaßnahmen. Darüber hinaus werden in Zukunft gerade bei nicht eindeutiger Situation zunehmend molekularbiologische Techniken zum Einsatz kommen. Das neue Micro-Array-Chip-Diagnose-System eröffnet neue Perspektiven in der raschen und zuverlässigen Diagnose von Rasenkrankheiten und ist somit auch ein wichtiges Werkzeug des integrierten Pflanzenschutzes im Greenkeeping.
Einige Spezifitäten bezüglich der Interpretation und Einbindung in Witterungszusammenhänge im Hinblick auf mögliche Prognosemodelle sind noch weiter zu klären und werden zurzeit untersucht. Auch die Bedeutung latenter und früher Infektionen für die weitere Pathogenese und Planung effizienter Maßnahmen sind Fragestellungen weiterer Untersuchungen.
1) Kooperation OMYA AG (CH), COMPO Expert (D) und OHS AG (CH)
Literatur
Gossmann,M. 2000: Occurrence and pathogenicity of Fusarium spp. on Miscanthus x gigantheus Greef & Deu. (China grass). In: NIRENBERG, H. (ed.), 6th European Fusarium Seminar, Third COST 835 Workshop of Agriculturally Important Toxigenic Fungi, Berlin, September 11-16, 2000, Book of Abstracts.
Joffe, A. Z., 1986: Fusarium species: Their Biology and Toxicology. John Wiley & Sons Inc., USA.
Lord, F. 2002: Untersuchungen zum Einfluss spezieller Rhizosphärenbakterien auf Pflanzenwachstum und Fusarium spp.-Toleranz bei Asparagus officinalis L., Diss. Humboldt Universität zu Berlin, 2002, 159 S.
Newton, C.R. et Graham, A. 1997: PCR. Introduction to Scientific Techniques. 2. Auflage. ed. BIOS Scientific Publishers, Oxford 1997.










