Biologische Bekämpfungsmöglichkeiten der Maulbeerschildlaus am Beispiel des Japanischen Schnurbaums in Berlin
von:Jonas Bless, Martin Schreiner, Guido Fellhölter, Barbara Jäckel, Claudia-Stefanie Schmid

Autoren: Jonas Bless, Martin Schreiner, Guido Fellhölter, Barbara Jäckel, Claudia-Stefanie Schmid
In den vergangenen Jahren konnten im Berliner Stadtgebiet eine Vielzahl neuer Schadorganismen an Gehölzen nachgewiesen werden (Pflanzenschutzamt Berlin 2020). Oftmals handelt es sich hierbei um wärmeliebende Organismen, die einerseits durch Zunahme an trocken-warmen Tagen während der Vegetationsperiode besonders im Stadtgebiet profitieren und andererseits Nutznießer der veränderten Klimabedingungen sind. Einer dieser neuen Schädlinge ist die eingeschleppte Maulbeerschildlaus (Pseudaulacaspis pentagona), die 2013 in Berlin erstmals in einer Baumschule vom Pflanzenschutzamt Berlin festgestellt wurde. Sie schädigt nicht nur Gehölze im Obst- und Zierpflanzenbau, sondern ist auch in den urbanen Bereich vorgedrungen.
Im Berliner Stadtgebiet sind neben dem Maulbeerbaum (Morus nigra) und Trompetenbaum (Catalpa bignonioides) vor allem Japanische Schnurbäume (Styphnolobium japonicum) vom Befall der Maulbeerschildlaus betroffen. Letztere sind wiederum aufgrund ihrer Hitze- und Trockenheitstoleranz für urbane Standorte besonders interessant und finden zunehmend Verwendung im Berliner Stadtgrün. Im nachfolgenden Artikel werden die Auswirkungen des Befalls der Maulbeerschildlaus auf den Schnurbaum, deren Biologie sowie mögliche nichtchemische Bekämpfungsansätze vorgestellt.
Biologie der Maulbeerschildlaus und Schadbild
Die aus Ostasien stammende Maulbeerschildlaus (Pseudaulacaspis pentagona, Abb. 1) gehört innerhalb der Familie der Deckelschildläuse (Diaspididae) zur Ordnung der Schnabelkerfe (Hemiptera) und gilt als ein thermophiler, stark polyphager Schadorganismus (Köhler & Kehr 2013), der sich mittlerweile weltweit etabliert hat (EPPO 2018). Erste Befallsmeldungen aus Deutschland an Johannisbeeren (Ribes) stammen aus dem Jahr 1964, was auf importiertes, befallenes Pflanzenmaterial zurückzuführen war (LTZ Augustenberg 2018). Die größten Distanzen legt P. pentagona durch den globalen Pflanzenhandel zurück. Eine weitere Verbreitung erfolgt ebenso über Wind und Verschleppung durch Schnittgut (Köhler & Kehr 2013, Herfarth 2018). Mehr als 130 Pflanzenarten zählen weltweit zu den Wirtspflanzen. Neben zahlreichen Obstbaukulturen der Gattungen Actinidia, Malus, Prunus, Pyrus, Ribes, Rubus und Vitis sind auch viele Ziergehölze für den urbanen Raum wie zum Beispiel Aesculus, Catalpa, Celtis, Juglans, Morus, Philadelphus, Quercus, Robinia, Styphnolobium, Tilia und Wisteria potenzielle Wirtsgehölze (LTZ Augustenberg 2018, Herfarth 2018, Cabi 2019).
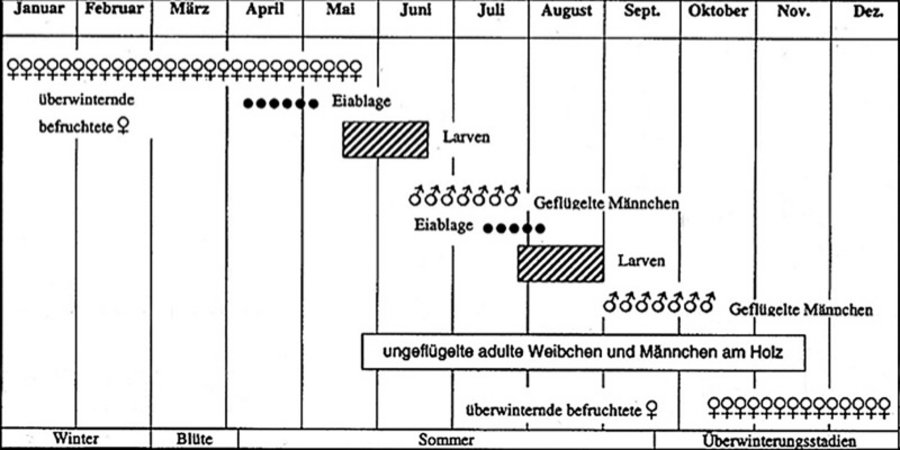
P. pentagona kann ein bis vier, teils fünf Generationen pro Jahr entwickeln und hat damit ein starkes Vermehrungspotenzial (Cabi 2019, Bennet & Brown 1958). Die Entwicklung aller Stadien ist dabei stark temperaturabhängig (Ball 1980, Erkilic & Uyguy 1997b, Takeda 2004, Abbasipour 2007). Ebenfalls temperaturabhängig ist die Fekundität der Weibchen, die bei 25 Grad Celsius am höchsten ist (Abbasipour 2007). Sie kann 100 bis 150 Eier unter ihrem Schild ablegen. Die Eier sind oval sowie gelblich bis orange gefärbt. Die unbeweglichen männlichen Larven bleiben in der Nähe der Mutterschilde, die weiblichen Crawler wandern bis zum einem Meter weit und besiedeln neue Triebe und Pflanzen. Bislang wurden in Süddeutschland nur zwei Generationen pro Jahr des Schädlings beschrieben (LTZ Augustenberg 2018) (Abb. 1). Die Larven durchlaufen mehrere Stadien und sind anfangs rötlich, längsoval, 0,2 Millimeter groß und haben noch keinen schützenden Schild ausgebildet. In Abbildung 2 ist der Lebenszyklus der Maulbeerschildlaus in Süddeutschland dargestellt.
Wie bei Deckelschildläusen üblich, hat P. pentagona ebenfalls einen ausgeprägten Geschlechtsdimorphismus (Mani et al. 1997), so unterscheiden sich die Eier und Larven von P. pentagona farblich voneinander. Rötlichfarbene Eier enthalten weibliche Embryonen und rosaweißliche Eier männliche Embryonen. Männchen sind sexuell dimorph, was auch anhand eines Farbunterschieds zu erkennen ist (Bennet & Brown 1958, Kuitert 1967), sie bilden im Spätfrühling und -sommer Flügel aus und ziehen damit den Weibchen hinterher.
NL-Stellenmarkt

Die Rinde der Bäume wird großflächig stammaufwärts bis in die Krone hinein von den länglichen wächsernen weißen Schilden der Männchen überzogen, welche den Bäumen einen weiß gekalkten Charakter verleihen (Harzer 2017; Abb. 3). Die Tiere schädigen ihre Wirtsbäume durch Saugtätigkeit an Rinden (Abb. 4), Blattstielen und Blättern, wodurch wiederum deren Vitalität beeinträchtigt wird. Besonders bei jungen Gehölzen kann durch die Abgabe von Toxinen im Speichel während der Saugtätigkeit Pflanzengewebe so geschädigt werden, dass es zu Welkeerscheinungen, einem gestörten Kronenaufbau und Absterbeerscheinungen führen kann.
Köhler & Kehr 2013 beschreiben zudem, dass diese Saugschäden wiederum Sekundarschäden durch Fusarium lateritium begünstigen könnten.
Bekämpfungsansätze
Im Rahmen des Integrierten Pflanzenschutzes, ist die Suche nach Alternativen zum chemischen Einsatz notwendig (§ 59 PflSchG). Erschwerend kommt hinzu, da für eine wirkungsvolle Bekämpfung der Maulbeerschildlaus (P. pentagona) aufgrund der Biologie des Insektes nur ein sehr begrenztes Zeitfenster zur Verfügung steht. In diversen Versuchen konnte nachgewiesen werden, dass Behandlungen mit ölhaltigen Insektiziden zur Zeit der höchsten Crawleraktivität die größten Mortalitätsraten mit sich bringen, da Crawler ohne wachsartigen Schilde am empfindlichsten sind (Kuitert 1967, Bazrafshan et al. 2010). Gleichzeitig ist eine Bekämpfung mit zugelassenen Insektiziden im öffentlichen Raum (sog. §17 Flächen PflSchG) aufgrund hoher Auflagen nicht überall praktikabel. Zudem spricht gegen eine chemische Bekämpfung die fehlende Selektivität zugelassener Präparate, sodass auch Populationen von Nichtzielorganismen und Ansiedlung von Gegenspielern der Maulbeerschildlaus beeinträchtigt werden könnten. Gleichzeitig muss auch die Gefahr von phytotoxischen Schäden an dünnrindigen Bäumen wie S. japonicum in Kombination mit hoher Sonneneinstrahlung berücksichtigt werden.
Im Rahmen mechanischer Bekämpfungsmethoden wird der Einsatz von Bürsten oder Hochdruckreinigern empfohlen. Neben möglichen Schäden an der Rinde spricht u.a. der hohe Arbeitsaufwand durch mehrfache Wiederholungen pro Jahr gegen diese Maßnahmen. Bei starkem Auftreten der Tiere kann an vitalen Bäumen ein intensiver Rückschnitt mit anschließender Vernichtung des Schnittguts den Befall reduzieren (LTZ Augustenberg 2018).
Im Bereich biologischer Bekämpfungsmaßnahmen konnte eine erfolgreiche Reduzierung des Schädlings mithilfe von Pheromonen (Verwirrung der Männchen) in Japan in Teefeldern nachgewiesen werden (Ozawa 2007). Weitere Angaben, diese Methode zur schwerpunktmäßigen Bekämpfung einzusetzen, liegen jedoch nicht vor.
Der Einsatz von Nützlingen als Antagonisten gegen die Maulbeerschildlaus konnte in der Vergangenheit vielfach untersucht und belegt werden (Howard 1916, Kobakhidze 1965, Kuitert 1967, Collins et al. 1975, Erkilic & Uyguy 1997a, Nicoli 1997, Kaneko et al. 2006, Rauleder 2011, Rauleder et al. 2016, Branscome 2019). Für den Einsatz an Stadtbäumen liegen bislang noch keine Erfahrungen vor. Diese Lücke soll mit der vorliegenden Untersuchung gefüllt werden.
Ausgehend von den beschriebenen Untersuchungen zum Nützlingseinsatz gegen die Maulbeerschildlaus am Japanischen Schnurbaum wurden von 2018-2021 Labor- und Feldversuche im Berliner Stadtteil Neukölln begonnen, um folgenden Fragen nachzugehen:
- Kann der Befall mit P. pentagona an S. japonicum mit aus dem Indoor-Bereich bekannten Nützlingen reduziert werden?
- Können sich Antagonisten von P. pentagona auf dem Straßenbaum S. japonicum saisonal oder auch dauerhaft in Berlin etablieren, um eine ausreichende Kontrolle der Maulbeerschildlaus zu erzielen?
- Wann ist der optimale Einsatzzeitpunkt für die Gegenspieler unabhängig vom Entwicklungszyklus von P. pentagona in Berlin? Ist eine praktikable biologische Bekämpfungsstrategie an Straßenbäumen möglich?
Material und Methodik
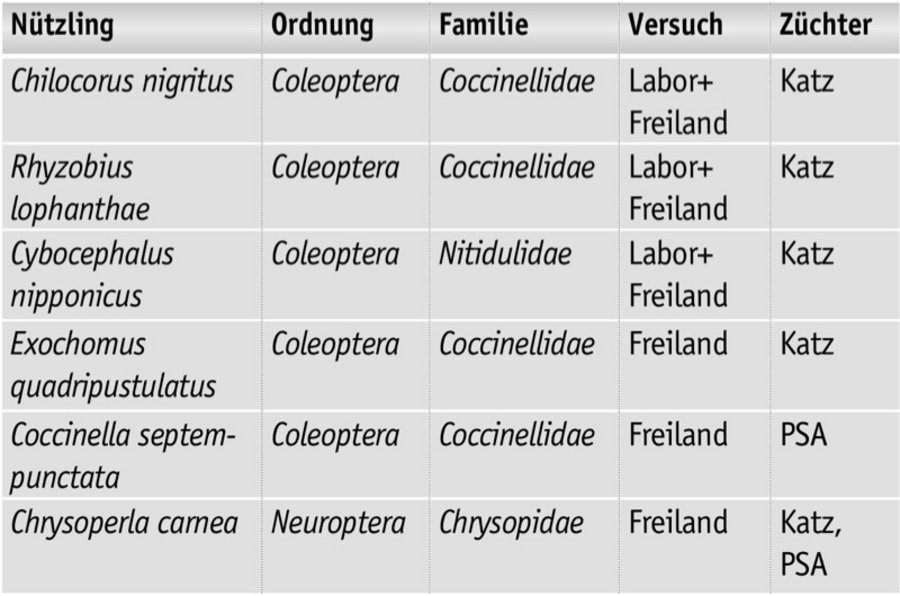
Resultierend aus den Fragen wurden die in Tabelle 1 dargestellten Nützlinge in den Labor- und Feldversuchen ausgewählt und eingesetzt.


Laborversuch
Im Labor wurden 20 cm lange belaubte Äste mit starkem Befall von S. japonica verwendet. In unterschiedlichen Käfigen wurden die aus dem Indoorbereich bewährten Marienkäfer-Arten C. nigritus, R. lophanthae und C. nipponicus direkt appliziert. Die Käfige befanden sich in einer Klimazelle mit einer konstanten Temperatur von 22 Grad Celsius und einer relativen Luftfeuchte von 60 Prozent. In der darauffolgenden Woche wurde täglich untersucht, ob ein Fraß der Nützlinge an P. pentagona stattfand.
Applikationstechnik für Nützlingseinsatz an Bäumen
Zum Zwecke der optimierten Nützlingsetablierung (Wasserversorgung, Unterschlupfmöglichkeit), wurden Applikationstaschen angefertigt. Um zu überprüfen, ob sich diese auf die Vitalität der Nützlinge auswirken, wurden folgende Systeme entwickelt: Filztaschen, Papierwabe, Grasknäuel, Grasknäuel in Papierrollen. Diese wurden nach dem Prinzip der Nützlingsansprüchen (Sonne, Wind, Schatten, Versteck und den Applikationsmöglichkeiten am Stadtbaum) ausgewählt. Die verschiedenen Applikationstaschen wurden mit den Nützlingen an den Versuchsbäumen nahe der Befallsherde in Höhen von 2 Meter befestigt. Kurz vor der Ausbringung der Nützlinge wurden die Taschen mit Wasser besprüht. Für die Bewertung der Effektivität der verschiedenen Applikationstaschen wurden folgende Bewertungsstufen festgelegt: 1= gut, 2 = mittel, 3 = schlecht, Zwischenstufen in der Bewertung waren möglich. Dabei wurden unter anderem Parameter für die Nützlingseignung, die technische Anwendung am Baum sowie das natürliche Abbaupotenzial des Ausbringungsmaterials mitberücksichtigt.
Feldversuch an Bäumen
Als Versuchsbäume dienten fünf S. japonica im Alter zwischen acht und zwölf Jahren. Die untersuchten Straßenbäume wurden laut Aufzeichnungen der Stadtbaumkampagne 2016 in Berlin-Neukölln mit einem massiven Befall durch P. pentagona eingestuft.
Da bisher keine Daten zum zeitlichen Entwicklungsverlauf der Maulbeerschildlaus in Berlin vorlagen, wurde in beiden Jahren ein Monitoring zur Crawlerentwicklung der P. pentagona durchgeführt. Dafür wurde an einem Versuchsbaum der genaue Entwicklungsverlauf auf einer gekennzeichneten Fläche wöchentlich fotografisch erfasst.
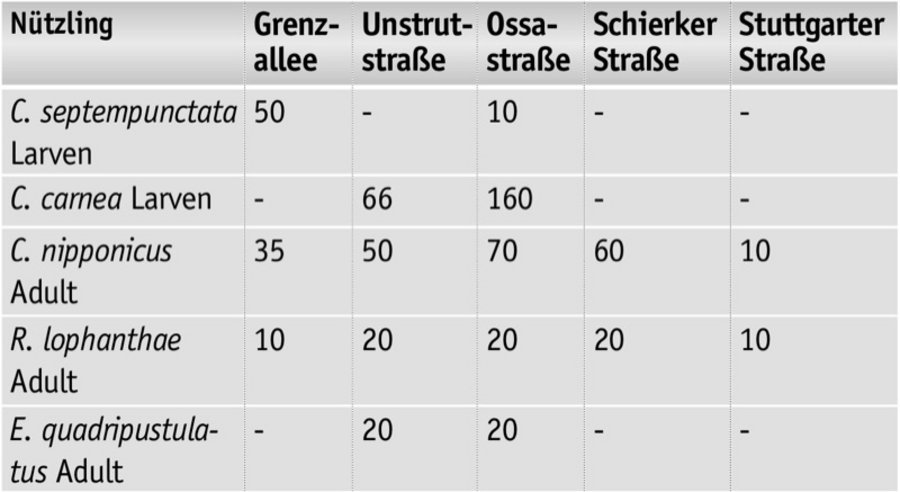
Die in der Tabelle 2 genannten Nützlinge wurden abhängig von der Verfügbarkeit als Larven oder Adulte im Zeitraum vom Mai bis Juli 2018 an den Standorten appliziert. Bonituren erfolgten regelmäßig im Untersuchungszeitraum einschließlich im Winter. Dabei wurden Parameter zur Populationsdynamik der Maulbeerschildlaus sowie der ausgebrachten und eingewanderten Gegenspieler erfasst.
Ergebnisse
Laborversuche
Alle drei im Labor getesteten Nützlinge R. lophanthae, C. nigritus und C. nipponicus zeigten unter kontrollierten Bedingungen einen Fraß an der Maulbeerschildlaus. Bei R. lophanthae und C. nipponicus konnte ein Fraß bereits mit dem ersten Tag bis zum Ende der Beobachtung dokumentiert werden. Letztgenannter zeigte sich über den gesamten Zeitraum deutlich aktiver als R. lophanthae. Bei C. nigritus hingegen setzte ein Fraß erst mit dem dritten Tag ein.
Applikationstechnik für Nützlingseinsatz an Bäumen
Die Variante Grasknäuel hatte die beste Gesamteinschätzung (1,25) der Varianten und wurde im Kriterium Schutz vor Austrocknung mit "mittel" (2), in allen anderen mit "gut" (1) eingestuft. Eine ähnlich gute Gesamteinschätzung (1,5) hat die Variante Papierrolle mit Grasknäuel. Sie zeigte "gute" Bewertungen beim Schutz vor Austrocknung und war regenbeständig. Hingegen konnte die Variante Filztasche in der Summe nicht überzeugen, wenngleich diese die beste Regenbeständigkeit (1) zeigte. Die Papierwaben zeigten die schlechteste (3) Regenbeständigkeit und darüber hinaus einen schlechten (3) Schutz vor Austrocknung. Die Mobilität des Nützlings wurde mit "mittel" (2) und die biologische Abbaubarkeit mit "gut" (1) bewertet.
Entwicklungsverläufe der 1. Crawlergeneration in Berlin 2018 und 2019
In beiden Jahren wurde der Entwicklungsverlauf der 1. Crawlergeneration der Maulbeerschildlaus in kurzen Zeitintervallen erfasst und dokumentiert. Diese entwickelte sich in beiden Jahren nahezu zeitgleich - der Schlupf fand 2018 am 18. Mai und 2019 am 20. Mai statt. Das Erreichen des L3-Crawlerstadiums erfolgte 2018 zum 08. Juni und 2019 zum 07. Juni.
Anzahl dokumentierter Nützlinge in 2018-2021 an den Straßenstandorten
2018 konnten umfangreiche Daten über die eingesetzten sowie zugewanderten Nützlinge an den Versuchsbäumen zusammengetragen werden. Die eingesetzten Larven heimischer Nützlinge C. carnea und C. septempunctata konnten an keinem Standort später nachgewiesen werden. Dies gilt auch für Marienkäfer C. nigritus und E. quadripustulatus für alle Standorte. Die eingesetzten C. nipponicus und R. lophanthae wurden an allen Standorten sowohl zeitnah nach der Applikation aber auch Wochen nach der letzten Einführung in sehr unterschiedlicher Menge an den Straßenbäumen fressend beobachtet. So konnten Ende September 2018 an ausgewählten Baumbereichen 73 C. nipponicus und 14 R. lophanthae gezählt werden. Diese beiden Käfer-Arten haben sich an den Standorten etabliert und vermehrt. Sie nutzten die Maulbeerschildlaus als Beute und konnten sich an den Standorten fortpflanzen.
Nach der Freisetzung der Nützlinge wurden die Versuchsbäume sowohl 2019 als auch 2020 und 2021 bonitiert, um zu klären, ob die ausgebrachten Nützlinge sich nach den Wintermonaten etablieren konnten (Abb. 5). In 2019 konnte lediglich am 15.03.2019 ein adultes Tier des freigesetzten Nützlings C. nipponicus an einem Versuchsbaum (Ossastr.) dokumentiert werden. Unvorhergesehene Baumpflegearbeiten hatten allerdings die Überwinterungsmöglichkeiten für Nützlinge stark beeinträchtigt. Aus der Umgebung zugewanderte Marienkäfer-Arten wurden mehrfach in beiden Jahren ab Juni an allen Standorten beobachtet und registriert. In größeren Stückzahlen wurden Larven und Adulte von Harmonia axyrides auf den Maulbeerschildläusen an allen Standorten festgestellt. Chilocurus bipustulatus war ebenso an fast allen Standorten zu finden. Auffällig hingegen in 2020 war, dass an drei von vier bonierten Versuchsstandorten insbesondere C. nipponicus in größeren Stückzahlen aufzufinden waren, obwohl diese in 2019 nur einmalig an einem Standort (Ossastr.) dokumentiert wurde. Am Spätsommertermin 2020, Ende August, konnte zudem an zwei Standorten einige wenige Exemplare von R. lophantae nachgewiesen werden. Dies wiederholte sich im Sommer 2021 an einem Standort.
Diskussion
Fraßversuche im Labor mit R. lophanthae, C. nigritus und C. nipponicus belegten, dass P. pentagona als Beute gefressen wird. Dies war auch zu erwarten, da diese Nützlinge auf den Fraß von Schildläusen spezialisiert sind (Katz Biotech 2019, Merkel et al. 2017, Smith & Cave 2006, Cabi 2019). Am besten wurde P. pentagona im Crawlerstadium bekämpft, da in den ersten Crawlerstadien noch keine schützenden Schilde ausgebildet sind. Dies gilt nicht nur für sämtliche Bekämpfungsmaßnahmen (Bazrafshan et al. 2010, Harzer 2017, Kuitert 1967), sondern bestätigte sich bei den Freilandversuchen zum Einsatz der Antagonisten in Berlin. Verschiedene Chilocorus-Arten (C. bipustulatus, C. renipustulatus und C. nigritus) und der Deckelschildlaus-Kugelkäfer (Exochomus nigromaculatus, Syn.: E. flavipes) wurden im Rahmen des Inva Protect "Nachhaltiger Pflanzenschutz gegen invasive Schaderreger im Obst- und Weinbau" (2008) bereits als Alternative zu den zugelassenen Insektiziden erwähnt (LTZ Augustenberg 2018).
Im Rahmen des Monitorings zur Populationsentwicklung der Maulbeerschildlaus war die 1. Crawlergeneration in beiden Jahren nahezu zeitgleich und ist mit der Populationsdynamik aus Süddeutschland vergleichbar (Tabelle 2). Zu beachten ist dabei, dass die Entwicklung aller Stadien von P. pentagona stark temperaturabhängig ist. Es ist daher davon auszugehen, dass die zeitliche Entwicklung der Crawlerpopulation von jährlichen Witterungsschwankungen abhängt und an diesen das Bekämpfungszeitfenster beziehungsweise Einsatzzeitpunkt von Gegenspielern angepasst werden muss (Ball 1980, Erkilic & Uyguy 1997b, Takeda 2004, Abbasipour 2007). Für eine erfolgreiche Etablierung von Gegenspielern ist es eine dringende Voraussetzung, die 1. Crawlergeneration als Beute nutzen zu können.
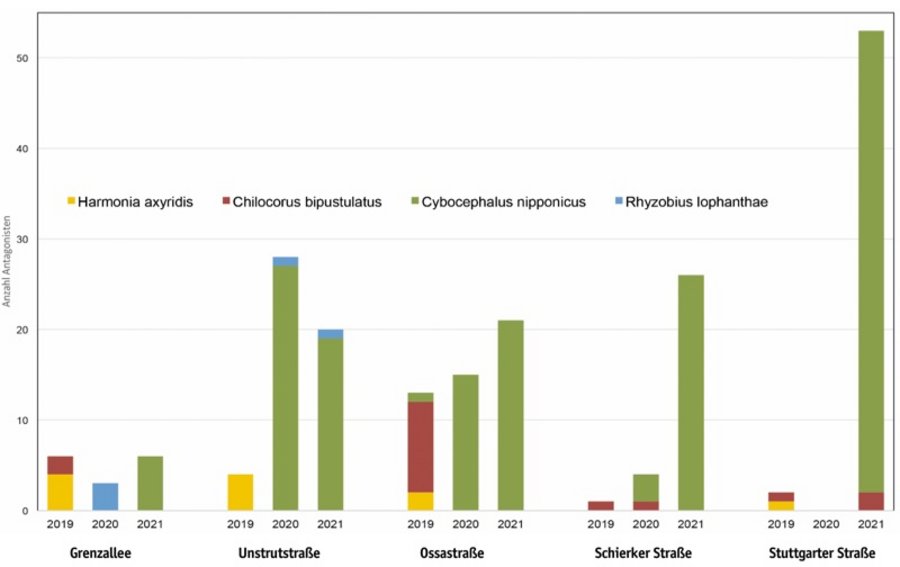
Die ausgebrachten heimischen Nützlinge C. septempunctata und C. carnea konnten an den Bäumen nicht wiedergefunden werden. Da sie nicht als Antagonisten der Maulbeerschildlaus gelistet (Cabi 2019) sind, ist davon auszugehen, dass sie Maulbeerschildläuse bislang nicht als Beute akzeptieren. Dem entgegen konnten in der Stadt natürlich vorkommende Gegenspieler, welche nicht im Versuch ausgebracht wurden, an der Rinde der Versuchsbäume über den gesamten Untersuchungszeitraum regelmäßig nachgewiesen werden. Dabei handelte es sich um den Asiatischen Marienkäfer (H. axyridis) und den Marienkäfer C. bipustulatus und C. nigritus. Ob ein Fraß der beiden erstgenannten Nützlinge an P. pentagona stattfand, konnte im Freiland nicht belegt werden. Dass H. axyridis ein Antagonist des Schädlings sein könnte, ist nicht bekannt. Dies müsste in Laborversuchen überprüft werden. Es ist jedoch nicht auszuschließen, dass er die ersten Crawlerstadien ohne Schilde frisst. C. bipustulatus gilt als natürlicher Prädator des Schädlings in der Türkei und auf Malta (Erkilic & Uyguy 1997a, Mifsud 1997). Es ist zu vermuten, dass dieser Marienkäfer bereits in Berlin als Antagonist von P. pentagona etabliert ist. Ebenso wurden nahe Verwandte, Chilocorus stigma und Chilocorus renipustulatus in Deutschland als Antagonisten bereits nachgewiesen (Kuitert 1967, Rauleder 2011, LTZ Augustenberg 2018). Hingegen konnte sich C. nipponicus in 2020 an vielen der untersuchten Bäume etablieren. Besonders am Standort Unstrutstraße dürfte die natürliche Etablierung erfolgreich gewesen sein. An diesem Standort konnte auch maßgeblich eine Populationsminderung der Maulbeerschildlaus nachgewiesen werden.
Zum Saisonende 2021 konnte festgestellt werden, dass sich C. nipponicus an allen Standorten dauerhaft etabliert hat. Gemeinsam mit den Marienkäfer-Arten C. bipustulatus und R. lophanthae wurde die Population von P. pentagona an den untersuchten Straßenbäumen auf einen tolerierbaren Befall minimiert.
Folgerung für Forschung und Praxis
Es ist in Zukunft davon auszugehen, dass mit der Einführung von Pflanzmaterial neue Organismen in den urbanen Bereich kommen werden und diese zu Schäden an Pflanzungen führen könnten. Deshalb ist es zum Beispiel wichtig, mehrjährig Neupflanzungen im Rahmen der Pflege zusätzlich auf eine mögliche Begleitfaune zu kontrollieren. Beim Erstauftreten nicht üblicher Arten sind für Stadtgebiete die üblichen Risikobewertungen seitens der Pflanzenschutzdienste erforderlich und es müssen Kenntnisse zur Biologie der Organismen in der Region erarbeitet werden, um gezielt Maßnahmen zur Minimierung beziehungsweise Duldung entwickeln zu können. Im Falle von P. pentagona in Berlin zeigte sich eine zu Süddeutschland vergleichbare Populationsentwicklung. Auf dieser Basis war es dann möglich, biologische Maßnahmen auszuwählen, nachdem mechanische Maßnahmen keinen dauerhaften Erfolg hatten. Mittels eines einjährigen Einsatzes, des aus dem Indoorbereich zur Minimierung von Deckelschildlaus-Arten genutzten antagonistischen Käfers C. nipponicus, konnte dieser über einen längeren Zeitraum an Straßenbäumen etabliert werden. Dieser hat dort die Beutepopulation von P. pentagona nach vier Jahren erfolgreich reduziert. Heimische Antagonisten haben nur zeitweise die Maulbeerschildlaus als Beute genutzt. Für biologische Verfahren im urbanen Raum müssen neben der Kenntnis der faunistischen Ausstattung und der Auswahl wirksamer Antagonisten zusätzlich geeignete Applikationstechnik entwickelt werden, da die Bedingungen im Vergleich zum Indoorbereich am Straßenstandort extremer und variabler sind. So muss zum Beispiel das Applikationsmedium die Gegenspieler am Extremstandort Straßenbaum vor Wind und Sonne schützen, mit Wasser versorgen, sich aber im Sinne der Nachhaltigkeit natürlich abbauen lassen. Wiederholtes Ausputzen von Applikationsmaterial ist am Straßenstandort nicht praktikabel. Diese Untersuchungen sind ein erfolgreiches Beispiel zur gezielten Nutzung biologischer Maßnahmen im urbanen Freiland.
Literatur
Abbasipour, H. (2007): Developmental time and fecundity of white peach scale, Pseudaulacaspis pentagona (Targioni-Tozzetti) (Homoptera: Diaspididae), on potato, kiwi and mulberry hosts in Iran. Pakistan Journal of Biological Sciences, 10, 18, 3220-3223.
Ball, J. C. (1980): Development and fecundity of the white peach scale at two constant temperatures. Florida Entomologist, 63, 1, 188-194.
Bazraffshan, M., Razmjou, J., Damavandian, M.R., Dastjerdi, H.R. (2010): Toxicity of serveral insecticides to white peach scale, Pseudaulacaspis pentagona Targioni (Hemiptera: Diaspididae). Munis Entomology & Zoology, 5, 1020-1024.
Bennett, F. D. und S. W. Brown (1958): Life history and sex determination in the Diaspine scale, Pseudaulacaspis pentagona (Targ.) (Coccoidae). Entomological Society of Canada, 90, 6, 317-324.
Branscome, D. (2019): Pseudaulacaspis pentagona. University of Florida, Gainesville, entnemdept.ufl.edu/creatures/orn/scales/white_peach_scale.htm, 21.06.2019.
Cabi [Hrsg.] (2019): Pseudaulacaspis pentagona. Centre for Agriculture and Bioscience International, Wallingford, www.cabi.org/isc/datasheet/45077.,14.06.2019
Collins, F. A. und W. H. Whitcomb. (1975): Natural enemies of the white peach scale, Pseudaulacaspis pentagona (Homoptera: Coccidea) in Florida. The Florida Entomologist, 58, 1, 15-21.
Eppo [Hrsg.] (2018): Pseudaulacaspis pentagona. European and Mediterranean Plant Protection Organization, Paris, gd.eppo.int/taxon/PSEAPE/distribution, 14.06.2019
Erkilic, L. und N. Uyguy. (1997a): Studies on the effects of some pesticides on white peach scale, Pseudaulacaspis pentagona (Targ.-Tozz.) (Homoptera: Diaspidae) and its side-effects on two common scale insect predators. Crop Protection, 16, 1, 69-72.
Erkilic, L. und N. Uyguy. (1997b): Development time and fecundity of the white peach scale Pseudaulacaspis pentagona in Turkey. Phytoparasitica, 25, 1, 9-16.
Harzer, U. (2017): Die Maulbeerschildlaus breitet sich weiter aus. Obstbau, 51, 12, 686-698.
Gesetz zum Schutz der Kulturpflanzen (Pflanzenschutzgesetz -PflSchG) (2012): Bundesgesetzblatt Jahrgang 2012 Teil I Nr. 7, ausgegeben zu Bonn am 13. Februar 2012, 148-182.
Harzer, U., Dahlbender, W., Sauter, J. (DLR), Köppler, K. Rauleder, H. Zimmermann, O. (LTZ), Frey, S. (Fredon Alsace) (2018): Die Maulbeerschildlaus am Oberrhein, Leitfaden zur Bedeutung, Verbreitung, Biologie, Erfassung und Monitoring sowie Bekämpfung.
www.km-bw.de ' get ' Maulbeerschildlaus_DL, 30.09.2021
Herfarth, F. (2018): Pflanzenschutz - Spezial Baumschule/Weihnachts-baumkulturen, Maulbeerschildlaus an Catalpa und Co. Landwirtschaftskammer NRW, 9, 3.
Howard L. O. (1916): Further Notes on Prospaltella Berlesei How., Journal of Economic Entomology, 9, 1, 179-181.
Katz Biotech AG [Hrsg.] (2019e): Cybocephalus nipponicus. Baruth, b2b.katzbiotech.de/biologischerpflanzenschutz/deckelschildlaeuse/771/cybocephalus-nipponicus, 24.06.2019.
Kaneko, S., A. Ozawa, T. Saito, A. Tatara, H. Katayama und M. Doi (2006): Relationship between the seasonal prevalence of the predacious coccinellid Pseudoscymnus hareja (Coleoptera: Coccinellidae) and the mulberry scale Pseudaulacaspis pentagona (Homoptera: Diaspididae), in tea fields: Monitoring using sticky traps. Appl. Entomol. Zool. 41, 4, 621-626.
Kobakhidze, D. N. (1965): Some results and prospects of the utilization of beneficial entomophagous insects in the control of insect pests in Georgian SSR (USSR). Entomophaga, 10, 4, 323-330.
Köhler J., R. Kehr (2013): Jahrbuch der Baumpflege 2013, Starkes Auftreten der Maulbeerschildlaus an Japanischen Schnurbaum im öffentlichen Grün. Haymarket Media GmbH & Co. KG, Braunschweig, 272-276.
Kuitert, L.C. (1967): Observation on the biology, bionomics and control of the white peach scale, Pseudaulacaspis pentagona (Targ.). Florida State Hortic. Soc., Gainesville, 376-381.
LTZ Augustenberg (2018): Die Maulbeerschildlaus am Oberrhein. Karlsruhe, www.km-bw.de/pb/site/pbs-bw-new/get/documents/MLR.LEL/PB5Documents/ltz_ka/%C3%9Cber%20uns/Grenz%C3%BCberschreitende%20Zusammenarbeit/InvaProtect/Leitf%C3%A4den/Maulbeerschildlaus_DL/Leitfaden_Maulbeerschildlaus.pdf, 10.05.2019.
Mani, E., F. Kozar, F. Schwaller (1997): Auftreten und Biologie der Maulbeerschildlaus Pseudaulacaspis pentagona (Targioni-Tozzetti) in der Schweiz (Homoptera: Diaspididae). Mitteilungen der Schweizerischen Entomologischen Gesellschaft, 70, 3-4, 399-408.
Merkel, O., B. Karolyi undKoranyi D. (2017): First record of Cybocephalus nipponicus in Hungary (Coleoptera: Cybocephalidae). Folia Ent. Hung. 78, 71-76.
Mifsud, D. (1997): Biological control in the Maltese Islands - past initiatives and future programmes. Eppo Bulletin, 27, 77-84.
Nicoli, G. (1997): Biological control of exotic pests in Italy: recent experiences and perspectives. Eppo Bulletin, 27, 1, 69-75.
Ozawa, A. (2007): Conservation biological control of the mulberry scale, Pseudaulacaspis pentagona (Targioni), by IPM with communication disruption using sex pheromone to tea tortrixs. Proceedings of the 3rd International Conference on O-CHA (Tea) Culture and Science (ICOS 2007), www.o-cha.net/english/conference2/pdf/2007/files/PROC/Pr-P-407.pdf, 04.07.2019.
Pflanzenschutzamt Berlin (2020): www.berlin.de/pflanzenschutzamt/stadtgruen/schadorganismen-in-berlin/neue-schadorganismen/, 19.11.2020.
Rauleder, H. (2011): Antagonisten und Prädatoren der Maulbeerschildlaus Pseudaulacaspis pentagona (Targioni-Tozzeti, 1886) (Homoptera: Diaspididae) in Baden-Württemberg. Erwerbs-Obstbau, 53, 2, 51-58.
Rauleder, H., K. Schrameyer, O. Zimmermann (2016): Erstnachweis der räuberischen Gallmücke Lestodiplosis diaspidis (Kieffer, 1910) (Nematocera: Cecidomyiidae) als Prädator der Maulbeerschildlaus Pseudaulacaspis pentagona (Targioni-Tozzetti, 1886) (Homoptera: Diaspididae) in Deutschland. Erwerbs-Obstbau, 58, 4, 269-272.
Smith, T. R. und R. D. Cave (2006): Pesticide susceptibility of cybocephalus nipponicus and rhyzobius lophanthae (Coleoptera: Cybocephalidae, Coccinellidae). Florida Entomologist, 89, 4, 50-507.
Takeda, M. (2004): Effects of temperature on oviposition in overwintering females and hatch in first-generation larvae of Pseudaulacaspis pentagona (Homoptera: Diaspididae). Appl. Entomol. Zool., 39, 1, 15-26.